包装容器のエアリークテスト
包装容器のエアリークテスト


検査対象例
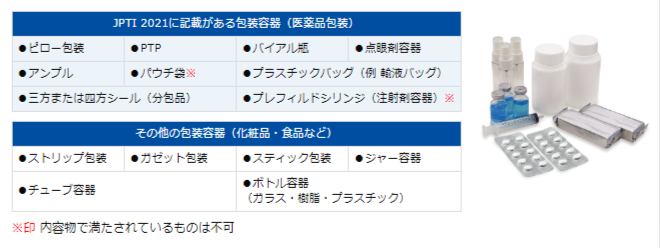
薬局方と完全性評価
漏れ試験の薬局方収載と理論確立
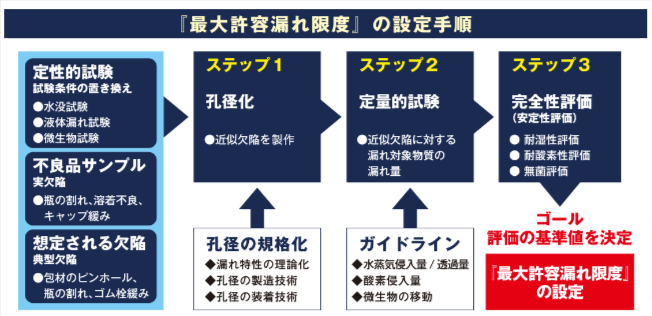
2021年6月、第十八改正日本薬局方参考情報に<無菌医薬品包装の完全性評価・漏れ試験法>が収載され、11種類の定性的・定量的な漏れ試験法が明示されるとともに、USP<1207>同様に「最大許容漏れ限度」による数値化・定量化が必要となりました。これは、品質保証の観点から、医薬品包装ごとに許容できる漏れの限度を決め、許容値以下になるよう定量的に管理をすることが医薬品包装の完全性評価の大きな命題となったことを意味しています。今回の改正では、包装設計や製剤設計の際にカギとなる「最大許容漏れ限度」が漏れの経路(孔)のサイズに対応していることが示されましたが、設定のための具体的手法は示されていません。
フクダでは、これまで産学官の関係者と連携しながら、USPを意識した完全性評価のよりどころとなる理論や手順をまとめ、判定基準・設定手順の体系化を進めてきました。「最大許容漏れ限度」による品質管理実現のため、漏れ試験装置の開発や擬似欠陥を利用した漏れ試験方法の確立など、実施方法を具体化しています。
医薬品包装の完全性試験(CCIT)
医薬品包装は、製剤の有効期間にわたり、水蒸気、酸素、微生物の侵入から保護し、「最大許容漏れ限度」を基準とした定量的漏れ試験の実施により、包装完全性を保証します。JP18およびUSP<1207>では、完全性評価の要件として、陽性対照(不良品サンプル)と陰性対照(良品サンプル)を用いた評価が推奨されています。
製造プロセス管理と品質保証
製造プロセス管理(漏れ試験装置の導入)
漏れ試験装置は、生産ラインの漏れ検査工程を完全自動化することができます。あらかじめ決められた品質基準により、包装容器の不良品を排出します。測定データは、改ざん防止のため、検査証跡(ログ)を残し、保護された形で出力されます。
品質保証(製剤の有効期間にわたり医薬品を保護する)
・包装容器の不良品を排除(ピンホール、不適切なシーリングなど)
・プロセスの最適化(包装機械などの条件の最適化、陽性対照による確認)
・気密性・密封性を確認し、リコール・訴訟・潜在的な欠陥不具合による損失から製造業者を保護する

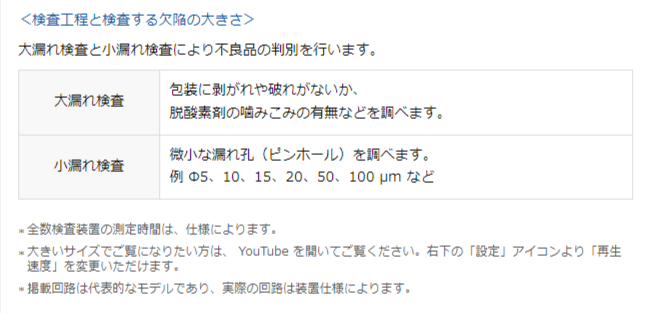
エアリークテストの測定原理
測定方法
包装容器の漏れ試験は、良品と不良品の圧力変化値を比較することで識別を行っています。測定方式は、タンク加圧式とタンク分圧式があり、包装容器の種類や形、試験条件などによって使い分けます。最適な漏れ試験を行うためには、お客様が検査する包装容器の形状・内容積・テスト圧力などを事前の検証実験にて確認する必要があります。それぞれの測定方式の動作は、下記のアニメーションよりご覧いただけます。ここでは、空気の流れを色で示し、バイアル瓶を例として良品と不良品の測定動作を紹介します。測定するサンプルをチャンバに入れ、加圧または減圧し、チャンバ内の圧力変化により漏れを検知します。サンプルに欠陥がある場合、包装容器内外を空気が移動するため、漏れがあることがわかります。測定時間は、トータル約20秒程度です。測定原理や試験条件など、ご質問がございましたらお問い合わせください。
回路動作(アニメーション)
・アニメーションは、<良品→不良品(小漏れ品)→ 不良品(大漏れ品)>の順に再生されます。
・正圧と負圧それぞれの動作をまとめています。
・アニメーションは、実際の測定時間とは異なります。
説明資料・動画
こちらから説明資料をダウンロードいただけます。
医薬品包装の完全性評価シリーズ
医薬品包装の完全性評価・完全性試験(CCIT)についてまとめた資料です。JP18に対応するため、医薬品包装の完全性評価の手段として漏れ試験を実施するまでの流れを<導入編・理論編・実践編>として全6回分にまとめました。このシリーズで公開している資料はベーシックな内容を中心としておりますので、さらに詳しい説明や具体的な数値化のご相談につきましては、下記よりお問い合わせください。
<導入編>
①USP・薬局方の動向
―定性的試験と定量的試験の違い―
②漏れ試験法と選定基準
<理論編>
③最大許容漏れ限度の設定
④漏れの理論と計算式の解説
<実践編>
⑤水没試験とエアリークテストの違い
⑥実験サンプル・製品